RAZTOPINE
Masni delež in topnost
Raztopina je zmes topljenca in topila. Sestavo raztopin izražamo na različne načine, pogosto kot masni delež topljenca v raztopini. Topnost je največja količina topljenca, ki se pri določeni temperaturi raztopi v določeni količini topila. Običajno jo navajamo z enoto g/100g topila. Topnost večine trdnih topljencev narašča s temperaturo (so izjeme). Nasičena raztopina je raztopina, ki vsebuje največjo možno količino raztopljenega topljenca pri določeni temperaturi. Topnost lahko hitro izračunamo iz masnega deleža topljenca po naslednji enačbi:
Topnost plinov
Na topnost plinov močno vplivata temperatura topila in tlak plina nad topilom. Čim višja je temperatura topila, tem slabše se plin raztaplja. Čim večji je tlak plina, tem bolj se plin raztaplja. Dober primer za preučevanje topnosti plinov so gazirane pijače.
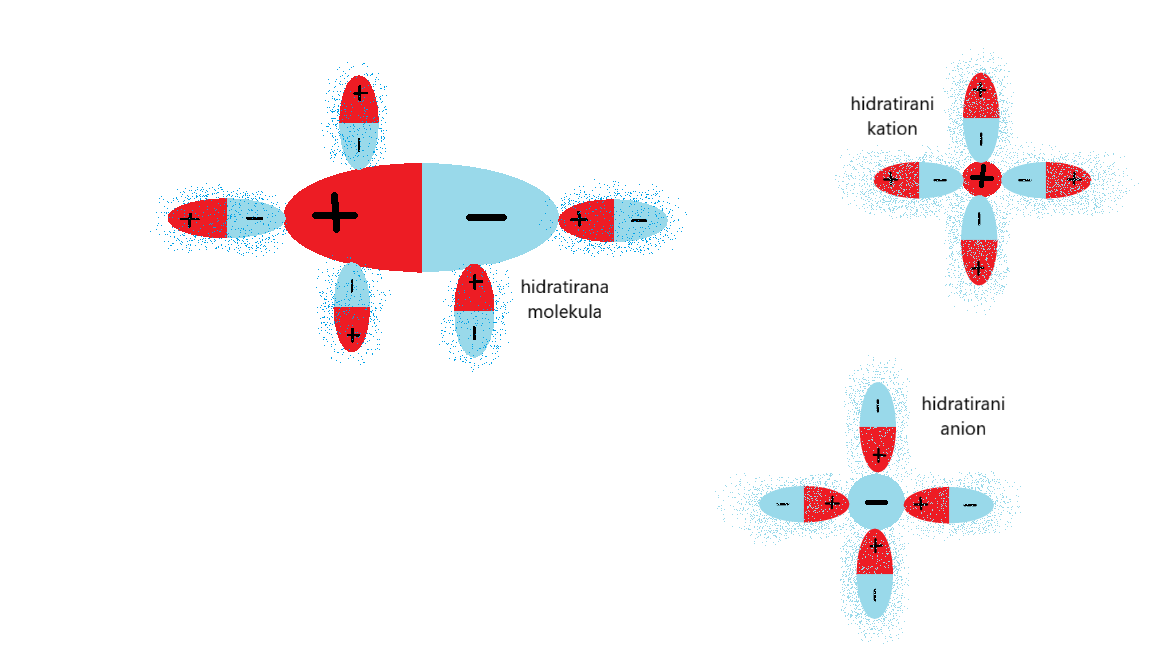
Hidratacija
Hidratacija je pojav, ko molekule vode obdajo delce topljenca. Pri tem nastanejo hidratirani ioni oz. hidratirane molekule. Ko topilo ni voda pa uporabljamo nadpomenko solvatacija ter solvatirane molekule oz. ioni.
Priprava raztopin, množinska in masna koncentracija
Raztopine pripravimo z redčenjem, koncentriranjem ali mešanjem obstoječih raztopin.
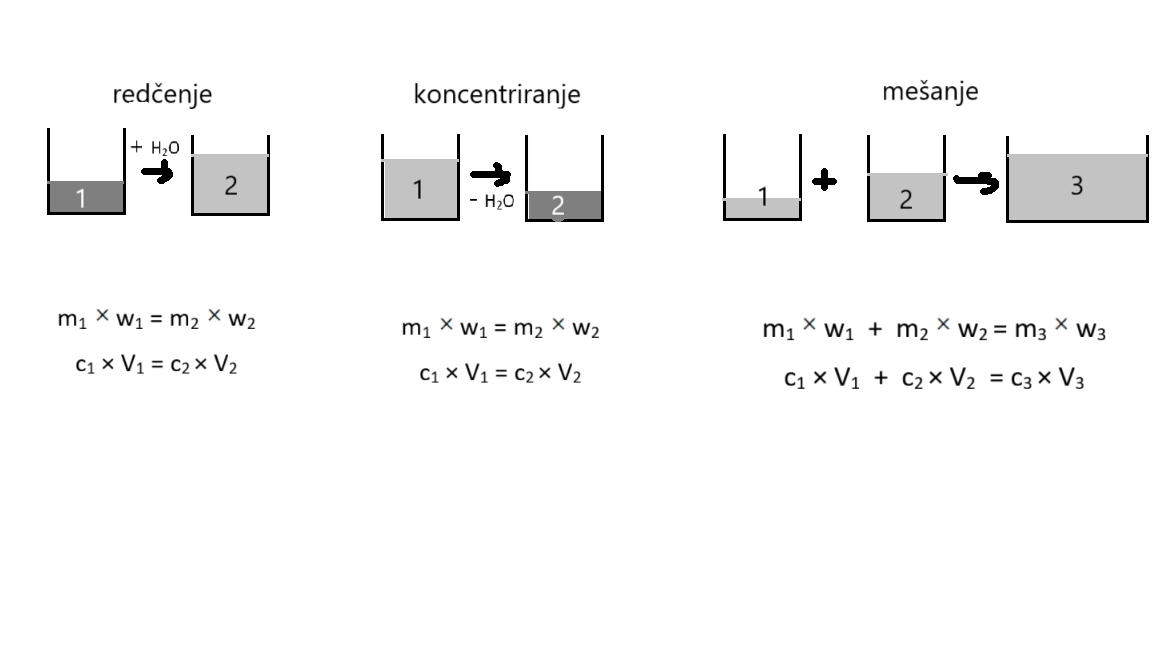
Množinsko koncentracijo (c) zračunamo kot količnik med množino (n) topljenca in volumnom (V) raztopine. Izrazimo jo z enoto mol/L oz. rečemo, da je npr. 7,13 molarna (M). Masna koncentracija (γ) je količnik med maso (m) topljenca in volumnom (V) raztopine, ki jo izrazimo z enoto g/L.
