POVEZOVANJE DELCEV
Imenovanje elementov
Poznamo 118 elementov, ki jih označujemo z enočrkovnimi ali dvočrkovnimi simboli (npr. H in He). Prva črka je vedno velika, druga majhna. Nekateri elementi tvorijo dvoatomne ali več atomne molekule.
- Vodik (H2)
- Dušik (N2)
- Kisik (O2 in O3 - ozon)
- Elementi VII skupine
- Fosfor ----> beli fosfor (P4)
- Žveplo (S8)
Pri sobnih pogojih sta dva elementa v tekočem agregatnem stanju (Hg, Br2). Plinasti elementi so H2, O2, N2, F2, Cl2, VIII (žlahtni plini), ostali elementi so v trdnem agregatnem stanju.
Imenovanje binarnih spojin
Binarna spojina je spojina iz dveh elementov (npr.: H2O).
Spojine imenujemo v skladu s pravili IUPAC (International Union of Pure and Applied Chemistry). Binarne spojine lahko imenujemo na tri načine:
- s števniki (množilnimi predponami)
- po Stock-u (z oksidacijskim številom)
- po Ewens-Bassett-u (z nabojnim številom)
Npr.: N2O5
- dušikov pentaoksid
- dušikov(V) oksid
- dušikov(5+) oksid
Formule binarnih spojin
Elementi VIII skupine so vedno na prvem mestu (XeF2, XeO4).
Če imamo v binarni spojini elementa iste skupine, je prvi tisti, ki je nižje v skupini (SO2, P3N5).
Če imamo v binarni spojini elementa različnih skupin, je element, ki se nahaja bolj levo, pisan prvi (NO, CO2, BF3).
Vodik pišemo na prvo mesto, če je v spojini vezan z elementom VII ali VI skupine (H2O, HCl, HF).
Ionska in kovalentna vez
Značilnosti ionske vezi:
- Običajno nastane med kovino in nekovino (NaCl), izjema so tudi amonijeve soli (NH4+ --> NH4Cl).
- Nastane tako, da kovina odda elektron(e), nekovina ga sprejme, pri tem nastanejo kovinski kationi in nekovinski anioni.
- Ionska vez ni usmerjena, ionske vezi ne prikažemo s črtico.
Značilnosti kovalentne vezi:
- Običajno nastane med atomi nekovin.
- Atomi nekovin si delijo, imajo skupne/vezne elektronske pare.
- Ločimo med nepolarno kovalentno vezjo (povezuje enake atome nekovin) in polarno kovalentno vezjo (povezuje atome različnih nekovin).
- Kovalentna vez je usmerjena, prikažemo jo kot črtico.
Valenčni ali zunanji elektroni so elektroni v zadnji/zunanji lupini, njihovo število je enako skupini periodnega sistema v kateri se nahaja element.
Struktura molekul
Molekule imajo različno obliko.
| OBLIKA | KOT MED VEZMI | PRIMER |
|---|---|---|
| linearna oblika | 180° | CO2 |
| kotna oblika | 104.5° | H2O |
| trikotno-planarna oblika | 120° | BF3 |
| trikotno-piramidalna oblika | 107° | NH3 |
| tetraedrična oblika | 109,5° | CH4 |
| trikotno-bipiramidalna oblika | 120°, 90° | PF5 |
| oktaedrična oblika | 90° | SF6 |
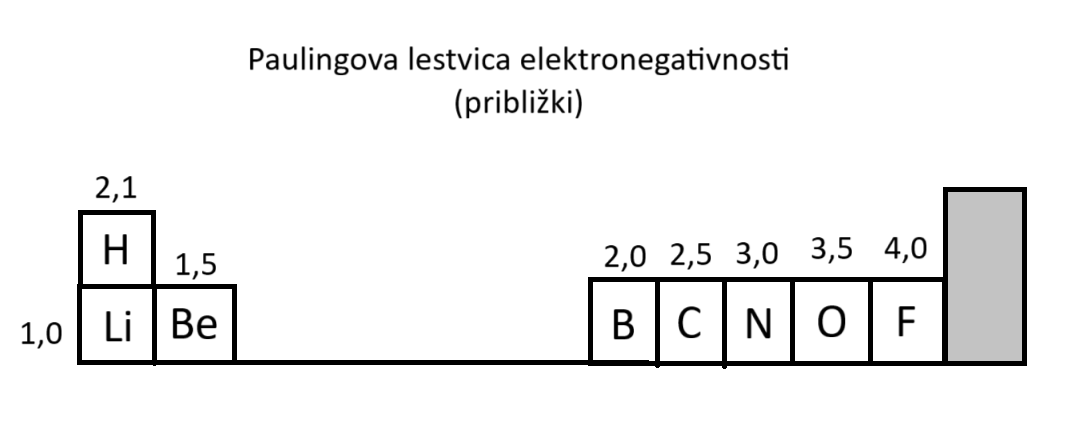
Elektronegativnost elementov, polarnost spojin
Elektronegativnost je sposobnost atoma elementa, vezanega v spojini, da privlači elektrone.
Elektronegativnost narašča v periodnem sistemu diagonalno desno navzgor (neupoštevamo žlahtnih plinov).
Elektronegativnost oz. elektropozitivnost označimo z malo grško črko delta.
Če je razlika v elektronegativnosti med vezanima elementoma v spojini zelo velika, potem je spojina ionska (npr.: LiF).
Če je razlika v elektronegativnosti med vezanima elementoma v spojini majhna, potem je vez polarna kovalentna (npr.: H2O).
Če je razlika v elektronegativnosti med vezanima elementoma v spojini enaka nič, potem je vez nepolarna kovalentna (npr.: H2).
Spojina je polarna, če ima en del njene molekule drugačno elektronsko gostoto, kakor drugi del molekule. Pravimo, da ima molekula dipol (dva pola).
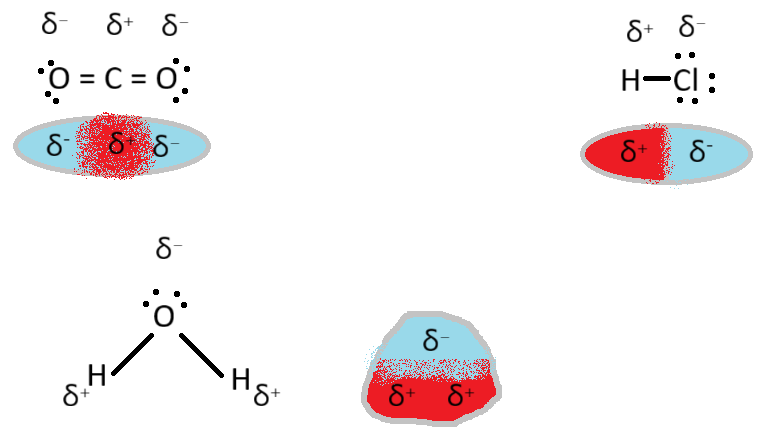
Medmolekulske/Molekulske sile/vezi
Medmolekulske/Molekulske sile/vezi delujejo med molekulami in tudi med atomi žlahtnih plinov. Te sile oz. vezi so zelo šibke (bistveno šibkejše od kovalentnih in ionskih vezi) in delujejo na kratkih razdaljah.
Delimo jih na:
- disperzijske sile (najšibkejše, med nepolarnimi molekulami, atomi žlahtnih plinov)
- indukcijske sile (med polarno in nepolarno molekulo)
- orientacijske sile (med polarnimi molekulami)
- vodikova vez (najmočnejša)
Disperzijske, indukcijske in orientacijske sile včasih imenujemo van der Waalsove sile.
Vodikova vez je posebno močen privlak med molekulami, v katerih je vodik vezan na fluor, kisik ali dušik.
Spojine, ki tvorijo vodikovo vez, imajo nekatere nenaravne (anomalne) lastnosti.
Anomalne lastnosti vode:
- nenavadno visoko vrelišče (100°C)
- nenavadno spreminjanje gostote s temperaturo
- nenavadno visoka talilna, izparilna in specifična toplota oz. energija
Lastnosti in zgradba trdnih snovi
Trdne snovi so lahko kristalične (imajo urejeno Strukturo) ali amorfne (nimajo urejene Strukture).
Med amorfne snovi uvrščamo steklo in plastiko.
Poznamo 4 vrste kristaličnih snovi - kristalov:
| KRISTALI | IONSKI | MOLEKULSKI | KOVINSKI | KOVALENTNI |
|---|---|---|---|---|
| PRIMERI | NaCl | CO2, H2O, I2 | Fe, Al, W | SiO2 (kremen), SiC (karborund), C (diamant), B |
| VRSTE VEZI | ionska | molekulske | kovinska | kovalentna |
| GRADNIKI | ioni | molekule | atomi kovin | atomi nekovin |
| LASTNOSTI | visoko tališče, prevajajo električni tok v talini in raztopini, krhki | nizko tališče, električnega toka ne prevajajo, krhki | raznolika tališča, prevajajo električni tok, kovne, tanljive | visoko tališče, električnega toka ne prevajajo, zelo trdi |
Osnovne celice
Osnovna celica je del kristalne mreže (kristala), ki se ponavlja v vse tri smeri v prostoru.
Osnovne celice imajo različne oblike in velikosti. Obravnavamo samo kubično osnovno celico (kubični kristalni sistem).
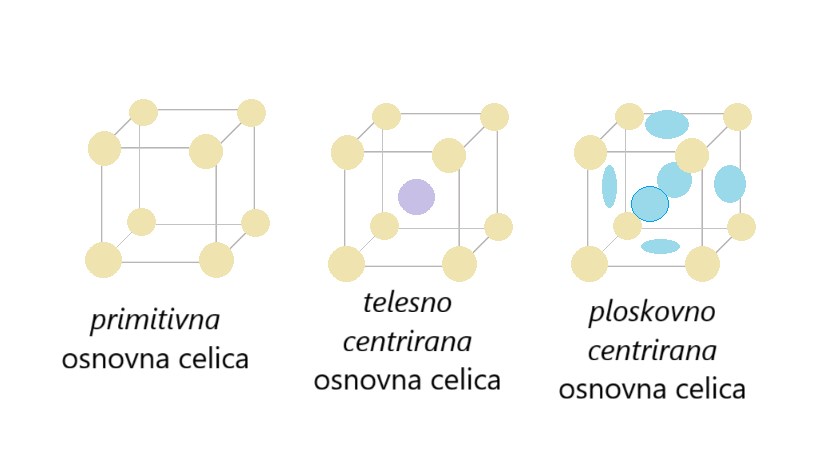
Koordinacijsko število - število istovrstnih gradnikov, ki so v neposredni bližini opazovanega gradnika.
Alotropija je pojav, ko se element pojavlja v različnih oblikah (alotropnih modifikacijah), ki se razlikujejo v fizikalnih in kemijskih lastnostih (npr. ogljik: diamant, grafit,...).
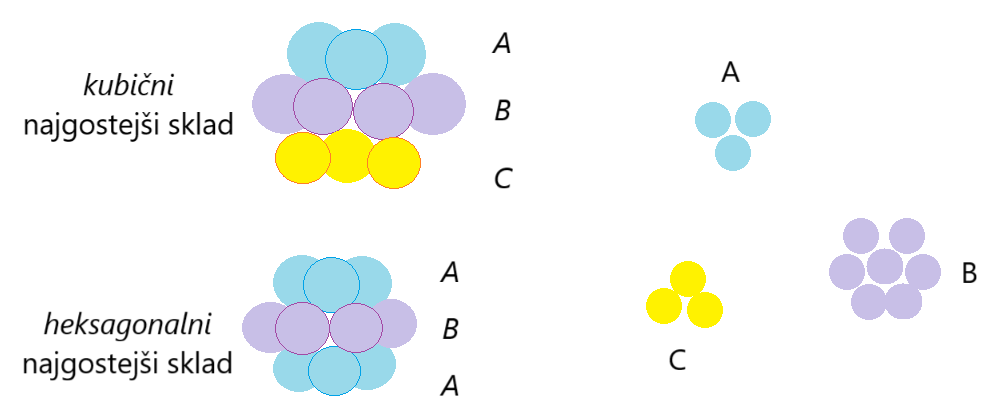
Kovine katalizirajo na različne načine. Zelo pogosta pa sta kubični najgostejši sklad (v nadaljevanju KNS) in heksagonalni najgostejši sklad (v nadaljevanju HNS).
KNS in HNS imata oba Koordinacijsko število 12, različna pa je razporeditev plasti.
KNS ima plasti v zaporedju ABC ABC ABC.
HNS ima plasti v zaporedju AB AB AB.
Kovinska vez je privlak med kovinskimi atomi, ki imajo skupne, prosto gibljive valenčne elektrone (zaradi njih prevajajo električni tok).