DELCI V SNOVI
Delci v atomu
Atom je najmanjši delec s kemijskimi lastnostmi določenega elementa. Zgrajen je iz zelo majhnega jedra, v katerem so nevtralni nevtroni in pozitivni protoni, ter elektronska ovojnica, v kateri so negativni elektroni.
Masa protonov in nevtronov je bistveno večja od mase elektronov, zato je skoraj vsa masa atoma zbrana v njegovem jedru.
V atomu je število protonov enako številu elektronov, naboja protonov in elektronov sta enako velika, a nasprotna po predznaku (+,-), zato je atom navzven električno nevtralen - nima naboja.
Atom je prib. 100000-krat večji od jedra.
Vrstno in masno število
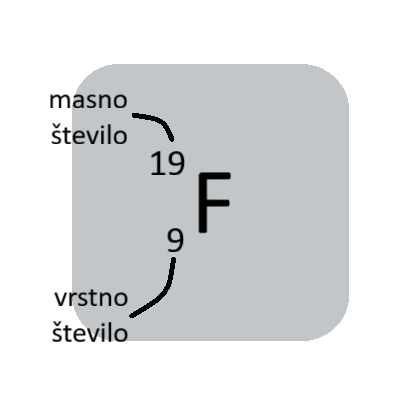
Vrstno (atomsko) število je enako številu protonov v jedru atoma. Najdemo ga v periodnem sistemu.
Masno število je vsota protonov in elektronov (nukleoni - delci v jedru). Masnega števila ni v periodnem sistemu.
Vrtsno število zapisujemo levo spodaj, masno število pa levo zgoraj ob simbolu elementa.
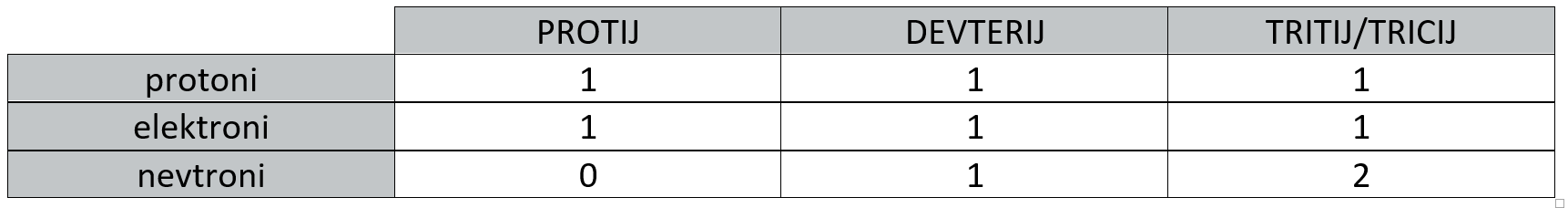
Izotopi
Izotopi so atomi istega elementa, ke se med seboj razlikujejo v masnem številu. Razlikujejo se tudi v številu nevtronov, fizikalnih lastnostih (tališče, vrelišče, gostota,...) in razširjenosti v naravi.
Relativna atomska masa
Relativna atomska masa je število, ki nam pove kolikokrat je masa atoma določenega elementa večja od 1/12 mase ogljikovega izotopa C 12.
Izračun relativne atomske mase
Relativno atomsko maso elementa lahko izračunamo iz podanih relativnih atomskih mas posameznih izotopov in njihove razširjenosti v naravi.
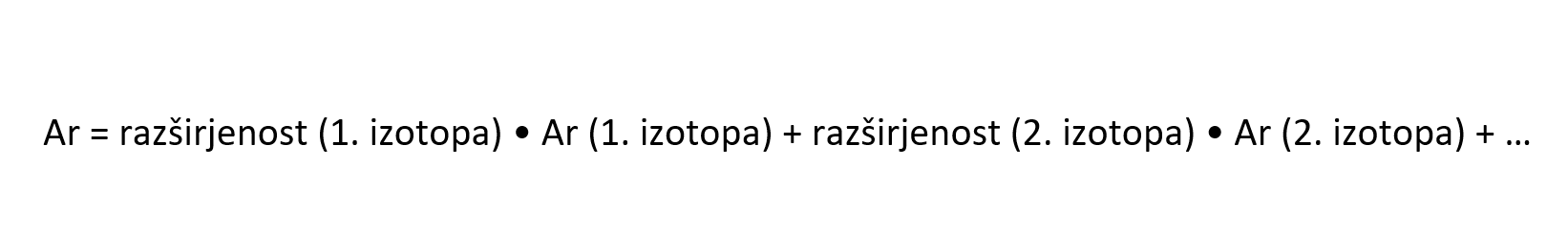
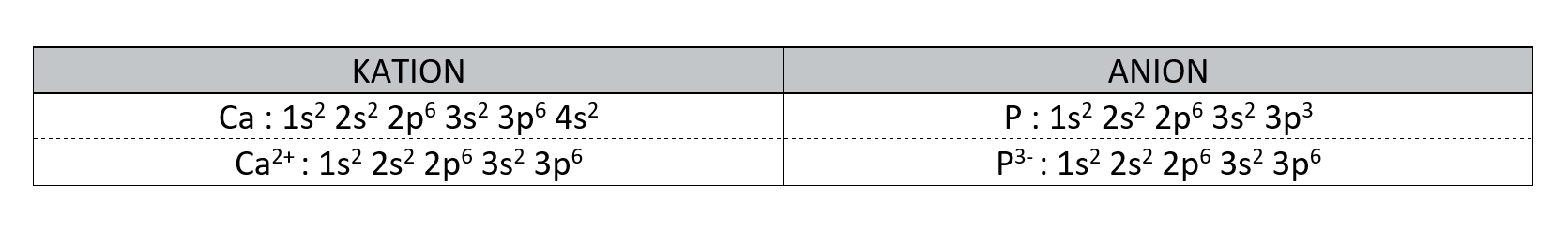
Ioni
Ioni so delci z nabojem. Poznamo pozitivne ione - katione in negativne ione - anione. Kation ima manj elektronov kakor atom iz katerega je nastal. Anion ima več elektronov kakor atom iz katerega je nastal.
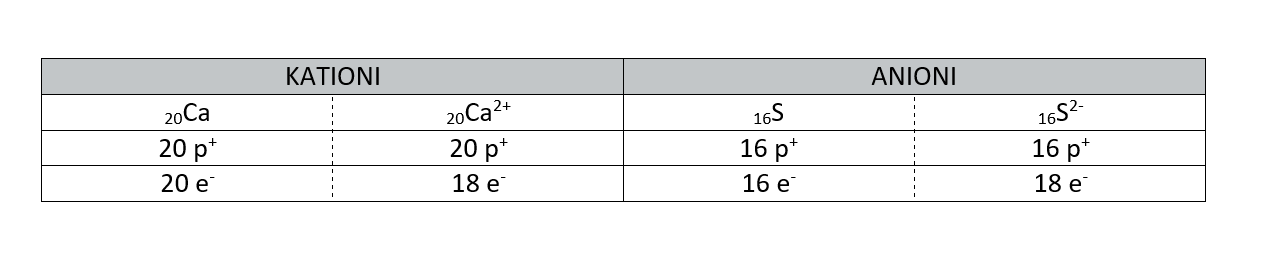
Vodik lahko tvori kation H+ ali anion H-.
Elektronska ovojnica
Elektronska ovojnica je prostor okoli jedra, v katerem se gibljejo elektroni. Elektroni so premajhni in se gibljejo prehitro, da bi jih lahko videli. Elektronsko ovojnico lahko razdelimo na orbitale. Orbitala je prostor, v katerem se s 95% verjetnostjo nahaja elektron.
Poznamo različne vrste orbital.
Orbitale se razlikujejo po:
- obliki: s-orbitale, p-orbitale, d-orbitale, f-orbitale
- velikosti: 1s orbitala, 2s orbitala, 3s orbitala, 4s...
- orientaciji v prostoru: px,py, pz...
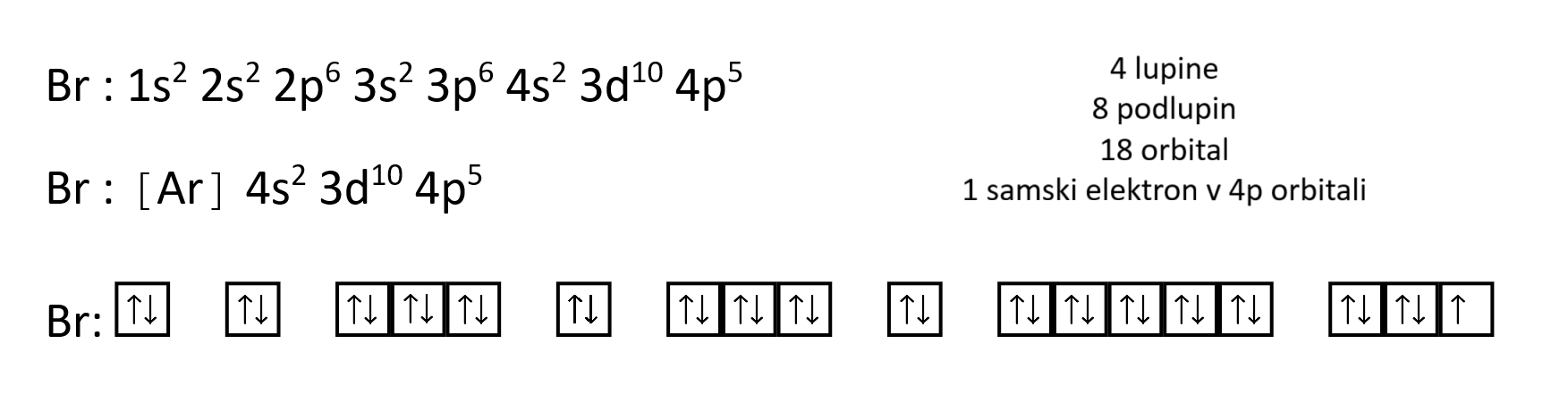
Elektronska konfiguracija je razporeditev elektronov po orbitalah.
Elektronsko konfiguracijo lahko krajše zapišemo s simbolom žlahtnega plina, ki je v periodnem sistemu pred iskanim elementom, nato pa dopišemo še preostale orbitale.
Grafično zapišemo elektronsko konfiguracijo s pomočjo kvadratkov znotraj katerih sta dve puščici obrnjeni v nasprotno smer.
Pravila, ki se jih držimo pri zapisovanju elektronske konfiguracije elementov:
- PAULIJEVO IZKLJUČITVENO NAČELO: V vsaki orbitali sta lahko največ dva elektrona, ki imata nasprotna spina - dvojici pravimo tudi elektronski par.
- HUNDOVO PRAVILO: Če imajo elektroni na razpolago več energijsko enakovrednih orbital, potem jih zasedajo posamično.
- PRINCIP IZGRADNJE:Elektroni najprej zasedejo orbitale z najmanjšo energijo. Vrstni red polnjenja orbital: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d...
Ionizacijska energija
Ionizacijska energija (Eix) je energija, ki jo moramo dovesti atomu ali ionu plinatega elementa v njegovem osnovnem stanju, da mu odstranimo elektrone (endotermen proces).
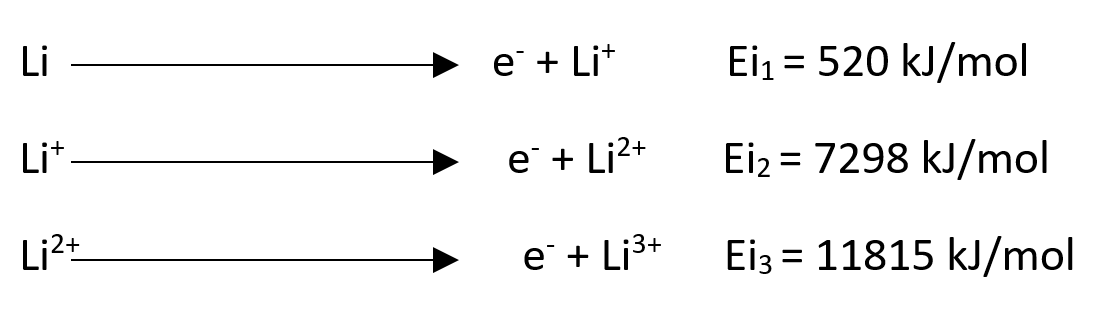
Prve ionizacijske energije se po skupini navzdol manjšajo, po periodi desno pa se večajo.
Atomski in ionski polmeri
Atomski polmeri se po skupini navzdol večajo, po periodi desno pa manjšajo.
Kationi so manjši, anioni pa večji od atomov istega elementa.