MNOŽINA SNOVI
Molska masa
Molska masa je masa enega mola snovi. Številčno je enaka relativni atomski masi oz. relativni molekulski masi, a ima enoto g/mol.
Izrečun množine snovi
Množina snovi je ena od sedmih osnovnih veličin
Osnovna enota za množino snovi je mol. En mol vsebuje prib. 6,02*10^23 delcev (Avogadrova konstanta).
Množino snovi izračunamo z enačbo:
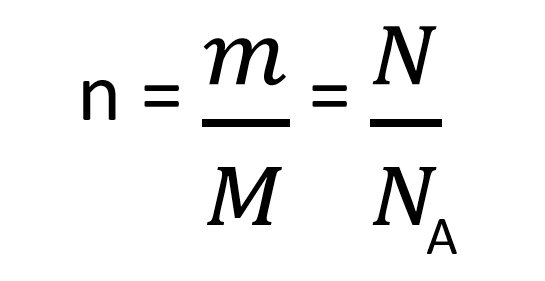
Množina atomov, množina molekul
Kadarkoli imamo podano eno snov, iščemo pa drugo snov, naredimo:
- razmerje množin
- križno množimo
- vstavimo ustrezno enačbo
- izrazimo iskano veličino
- vstavimo podatke in izračunamo
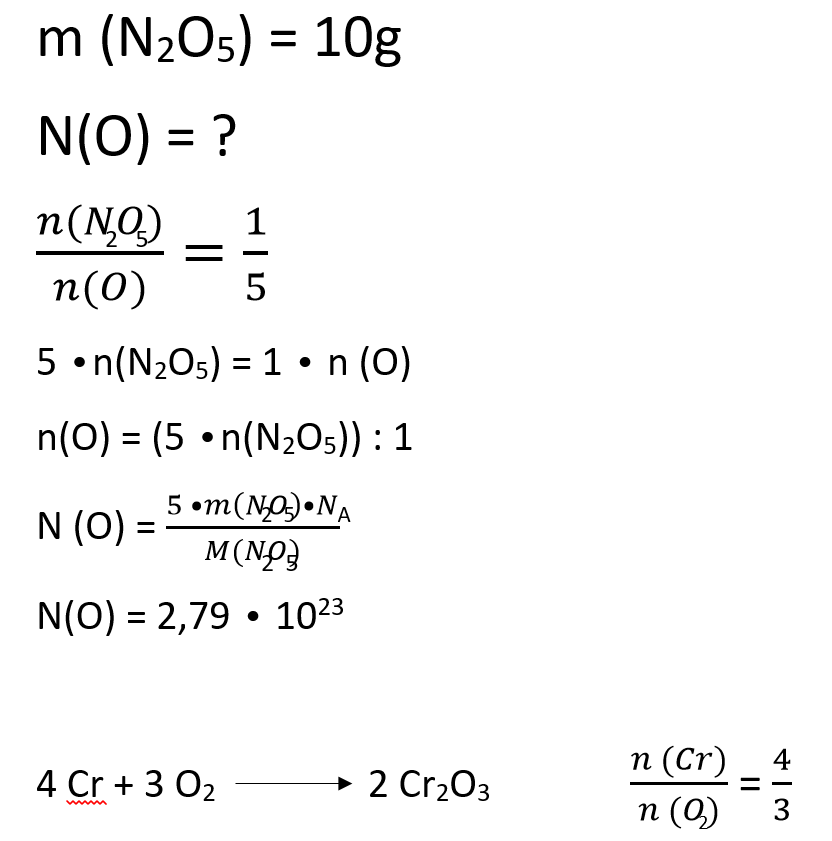
Prostornina plina
Pline opišemo z veličinami množina, prostornina, tlak in temperatura. Pri tem uporabimo ti. splošno plinsko enačbo (velja za idealne pline).
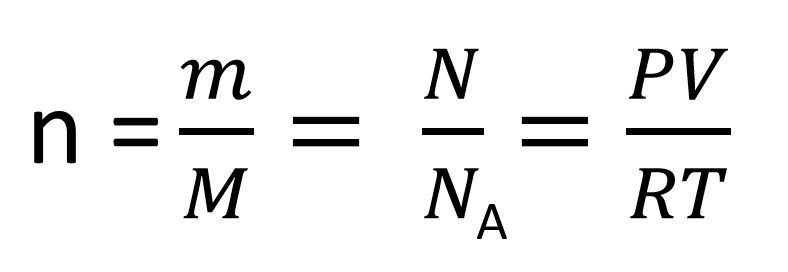
Molska prostornina
Molska prostornina je prostornina 1 mol snovi. Izračunamo jo z enačbo:
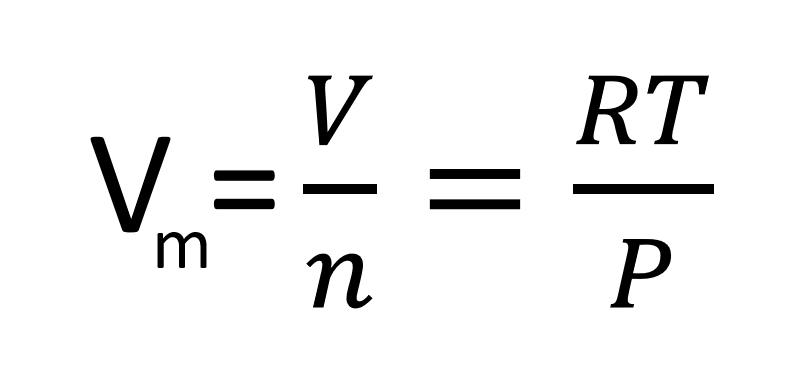
Enačba kemijske reakcije
Kemijsko reakcijo predtavimo z enačbo. V enačbi kemijske reakcije so na levi strani reaktanti, na desni pa produkti, vmes pa je puščica, ki predstavlja smer kemijske reakcije.
Enačba kemijske reakcije mora biti vedno urejena. Uredimo jo tako, da pred formule snovi pišemo najmanjše možne cele stehiometrične koeficiente. Številke 1 praviloma ne pišemo.
Včasih ob snoveh v enačbi kemijske reakcije pišemo tudi agregatna stanja snovi (g - plin, l - tekočina, s - trdno, aq - vodna raztopina). Agregatna stanja pišemo z navadno pisavo, desno od formule snovi.
Razlikujemo med kemijsko reakcijo in fizikalno spremembo. Pri kemijski reakciji nastane povsem nova/drugačna snov, pri fizikalni spremembi pa snov spremeni le svojo obliko.
Množinska razmerja
Količino snovi (reaktantov in produktov), ki sodeluje v kemijski reakciji lahko izračunamo z upoštevanjem množinskih razmerij. Postopek reševanja je enak kakor pri poglavju Množina atomov, množina molekul.
Presežek (prebitek) reaktantov
V primerih, ko sta podani količini dveh reaktantov je verjetno eden od njih v presežku (nezreagiran). Presežno količino reaktanta najlažje izračunamo preko množin.