Pri fizikalni spremembi in kemijski reakciji se energija lahko sprošča (takrat govorimo o eksotermni reakciji) ali porablja/veže (takrat govorimo o endotermni reakciji). S spremembo entalpije[Δ Hr]izražamo količino toplote, ki se sprosti ali porabi pri fizikalni spremembi ali kemijski rekciji.
Pri endotermnih reakcijah ima entalpija pozitivno vrednost, pri eksotermnih pa negativno.
O spremembi standardne reakcijske entalpije[Δ H°r][kJ]pa govorimo takrat, ko imamo opravka s termokemijsko enačbo (urejena kemijska enačba z agregatnimi stanji in navedeno vrednostjo entalpije).
Reakcijsko entalpijo za dano termokemijsko enačbo lahko izračunamo, če poznamo tvorbene entalpije snovi v tej enačbi. (n – množina snovi)
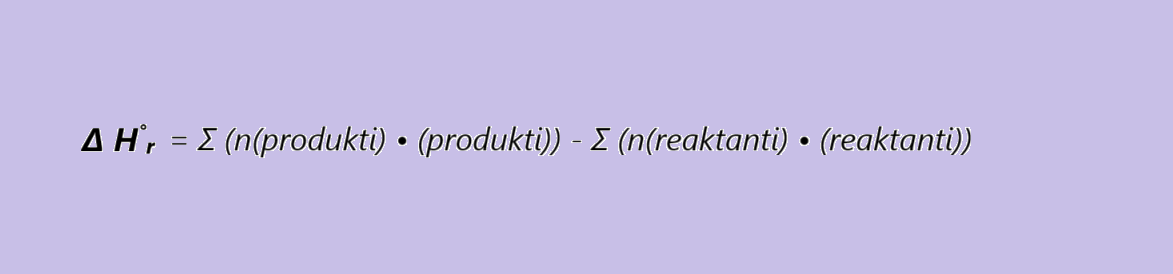
Energijo, ki se sprosti ali porabi pri nastanku 1 mol spojine iz elementov v njihovih standardnih (običajnih) stanjih, pa izraža standardna tvorbena entalpija [Δ H°tv /Δ H°t / Δ H°f / Δ fH°][kJ/mol].
Vsi elementi v standardnih stanjih (npr. kisik-> O2 (g)) imajo standardno tvorbeno entalpijo enako nič.
Pri prikazu energije v kemijski reakciji je zelo priročen energijski diagram